
Кой одобрява ваксините, които се използват в ЕС?
Ускореното одобрение на ваксините в ЕС означава ли, че стандартите за безопасност са занижени?
Как ЕС събира и анализира данните за странични ефекти от ваксините?
Какъв е случаят с руската ваксина Sputnik V?
 Божидар Ангелов е докторант по медийна политика и право на ЕС в катедра "Европеистика" на СУ "Св. Климент Охридски". Пътят му в журналистиката започва като стажант в телевизия BiT и регионалния център на БНТ в Благоевград. Редактор е в информационните сайтове News.bg и Money.bg, а по-късно става и водещ на новинарски блок на предаването Money.bg по телевизия Bulgaria ON AIR. Темата за борбата с дезинформацията и интересът му към проверката на фактите тръгват от президентските избори в САЩ през 2016 г. Година по-късно защитава магистърска теза на тема "Ролята на медиите за ограничаването на фалшивите новини (fact-checking)" в магистърска програма "Е-Европа".
Божидар Ангелов е докторант по медийна политика и право на ЕС в катедра "Европеистика" на СУ "Св. Климент Охридски". Пътят му в журналистиката започва като стажант в телевизия BiT и регионалния център на БНТ в Благоевград. Редактор е в информационните сайтове News.bg и Money.bg, а по-късно става и водещ на новинарски блок на предаването Money.bg по телевизия Bulgaria ON AIR. Темата за борбата с дезинформацията и интересът му към проверката на фактите тръгват от президентските избори в САЩ през 2016 г. Година по-късно защитава магистърска теза на тема "Ролята на медиите за ограничаването на фалшивите новини (fact-checking)" в магистърска програма "Е-Европа".
Ето фактите:
Как ваксините срещу COVID-19 бяха разработени толкова бързо?
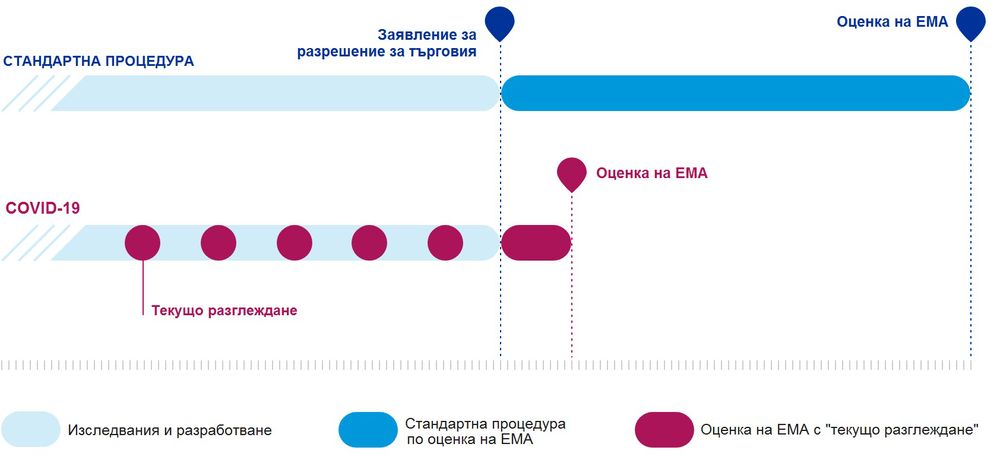
Ваксините срещу COVID-19 бяха създадени за около една година. Този факт често е използван като аргумент за тезата, че ваксините не са надеждни и безопасни. Това, което удобно се пропуска от защитниците на тази теза е, че учените изучават коронавирусите (към които принадлежи и SARS-CoV-2) от десетилетия. Благодарение на натрупаните знания и тяхното масово споделяне между учените по целия свят в началото на пандемията, геномът на новия коронавирус беше дешифриран още през януари 2020 г. Ускореното научно и технологично развитие позволява разработването на ваксини да става много по-бързо в сравнение с няколко десетилетия по-рано. А работата по иРНК-ваксините (каквито са тези на Pfizer-BioNTech и Moderna) не започва с откриването на новия коронавирус. Напротив, технологията вече е достатъчно усъвършенствана, а за да може тя да бъде използвана за създаването на първите ваксини срещу SARS-CoV-2, бяха мобилизирани огромни публични средства. През май 2020 г. по инициатива на ЕС световните лидери, организации и финансови институции се ангажираха да инвестират сумата от 8 млрд. долара в разработването на ваксини срещу COVID-19. ЕС е заделил 1 млрд. евро по програмата "Хоризонт 2020" за проекти, свързани с пандемията, от които поне 350 млн. евро са насочени към разработването на ваксини.
Кой одобрява ваксините, използвани в ЕС?
Медицинското одобрение на ваксините е отговорност на Европейската агенция по лекарствата (European Medicine Agency, EMA). Нейната основна задача е да разрешава употребата и да извършва мониторинг на лекарствата в ЕС. ЕМА се ръководи от Управителен съвет, в който участват представители от всяка държава членка на ЕС, както и на Европейската комисия, Европейския парламент и гражданското общество – организации на пациенти, на хуманни и ветеринарни лекари. Българският представител в съвета на ЕМА е директорът на Изпълнителната агенция по лекарствата (ИАЛ) Богдан Кирилов, а негов заместник е главният секретар на ИАЛ Светлин Спиров. Одобрението на даден продукт изисква подкрепата на две трети от представителите на всички държави и институции в Управителния съвет.
Занижени ли са стандартите за безопасност заради ускорените процедури по одобрение на ваксините?
През май 2020 г. ЕМА въведе ускорена процедура по оценка на ваксините срещу COVID-19, която, макар да скъсява сроковете, не променя етапите и изискванията към препаратите, нито понижава стандартите в оценяването. Процедурата на т. нар. "текущо разглеждане" позволява на Агенцията да провежда процеса по оценка, докато ваксините все още се разработват и преди да бъде подадено искане за разрешение за търговия. Разработчиците на ваксини периодично предоставят на ЕМА резултати от изпитванията по време на етапа на научноизследователска и развойна дейност, а не едва след приключването му, каквато е стандартната процедура. По този начин се спестява време, без да се пропуска нито една от фазите, гарантиращи безопасността на препаратите.
ЕС беше критикуван, че ЕМА се бави с одобрението на ваксините в сравнение с Великобритания например. Там първата ваксина (Pfizer-BioNTech) беше одобрена на 2 декември, a в ЕС – на 21 декември. Тогава председателят на ЕК Урсула фон дер Лайен оцени решението процедурите да се спазват стриктно като правилно: "Не може да има никакъв компромис, когато става дума за инжектиране на биологически активна субстанция в здрав човек".
Европейската комисия също ускори административните си процедури по издаване на разрешение за търговия – вместо стандартните 67 дни, включително 22 дни за консултации с държавите членки, ЕК започна да издава разрешения в срок от 3 дни след положителна препоръка от ЕМА. Разрешениятата обаче се издават "под условие" и за временна употреба, по време на която се провежда строг мониторинг, събират се допълнителни данни, производството се извършва по стриктни правила и др., а при необходимост ЕС може да предприеме регулаторно действие.
Продължават ли изследванията за безопасността на ваксините след одобрението им?
Работата на ЕМА не свършва, след като една ваксина бъде одобрена. Агенцията продължава да извършва засилен мониторинг на безопасността с цел откриване на нови или променящи се странични ефекти. Към края на май ваксинираните с поне една доза са над 222 млн. души, или над 40% от населението на ЕС. Това е огромна база данни, която дава възможност за последващи анализи. Производителите на ваксини също продължават да извършват изследвания и тестове на препаратите си. Предвид извънредната ситуация, производителите се ангажират да изпращат докладите си за безопасност до ЕМА всеки месец, а не на всеки шест месеца. От изключителна важност е прозрачността на тези процеси – ЕМА публикува регулярно допълнителните актуализации, обобщаващи докладите за безопасност на препаратите. На български език можете да ги откриете на интернет страницата на ИАЛ.
Как се докладват страничните ефекти от ваксините?
Съобщаването на възможни нежелани реакции след ваксинация е от решаващо значение. Всеки гражданин на ЕС може да информира за подозиран страничен ефект по два канала – към своя национален орган по лекарствата (в България това е Изпълнителната агенция по лекарствата – формуляр за немедицински лица, формуляр за медицински лица) или към производителя на ваксината. Всички доклади се събират в единна база данни за предполагаеми странични ефекти – EudraVigilance (Европейска база данни за подозирани нежелани лекарствени реакции), където се анализират. На посочения сайт всеки може да намери публични данни за случаите на странични ефекти, групирани в различни категории – време на докладване, държави, пол, разбивка по видове оплаквания и сериозността на случаите и др. Към края на май такива данни са налични и за четирите одобрени в ЕС ваксини – Pfizer-BioNTech, Moderna, AstraZeneca и Johnson and Johnson.
Как реагира ЕМА в случаите на нежелани реакции при някои ваксини срещу COVID-19?
Както всички лекарства, ваксините срещу COVID-19 могат да предизвикат нежелани реакции или странични ефекти, които са описани и информацията е публично достъпна. Въпросите около нежеланите реакции често стават обект на дезинформация, поради това е добре да се консултирате с лекар, вместо с интернет.
При ваксините на AstraZeneca и Johnson and Johnson беше установен много рядък страничен ефект, свързан с необичайно образуване на кръвни съсиреци, придружено от нисък брой на тромбоцитите. По отношение на ваксината на AstraZeneca, ЕМА и СЗО констатираха, че ползите надминават многократно рисковете и препоръчаха използването ѝ да продължи. Някои държави в ЕС обаче забраниха употребата на ваксината, въпреки че описаните нежелани реакции са много редки се срещат при по-малко от един на 100 000 души. Относно ваксината на Johnson and Johnson заключението на ЕМА отново гласи, че съотношението полза/риск на ваксината остава положително.
Как ЕС избира кои ваксини да разреши за употреба
Всяка компания, която разработва ваксина, може да подаде заявление за одобрение към ЕМА, като процедурите са еднакви за всички кандидати. Твърденията, че ЕС не желае да одобри руската ваксина Sputnik V по политически причини са част от активна пропагандна кампания на Русия (подробни данни и разобличаване вижте тук). Наложи се през февруари 2021 г. ЕМА да обяви официално, че не разглежда ваксината, защото производителят ѝ не е поискал това. Към 10 февруари 2021 г. руският Национален изследователски център по епидемиология и микробиология "Н. Ф. Гамалея" не е подал нито заявление за текущо разглеждане, нито искане за разрешение за пускане на пазара на ваксината. Едва от 4 март 2021 г. ваксината е в процес на текущо разглеждане от ЕМА, след като е постъпило заявление от германска компания.
Руският фонд за директни инвестиции обяви през последните седмици, че сключва партньорства за производството на Sputnik V с компании в Китай, Индия, Сърбия, Италия, Германия, Испания и Франция. За целта обаче компаниите в държавите членки на ЕС трябва да изчакат оценката на ваксината от ЕМА.
Законодателството на ЕС позволява на здравните власти на страните членки да издават собствени извънредни разрешения за използването на неодобрени от ЕМА ваксини. Разрешенията имат временен характер. В тези случаи отговорността пада изцяло върху въпросните държави. От тази възможност първо се възползва Великобритания, която одобри преди ЕМА ваксината на Pfizer-BioNTech. По-късно от това право се възползва и Унгария, която одобри извънредно руската ваксина Sputnik V, а впоследствие и китайската Beijing CNBG на Sinopharm. Към края на май Унгария е единствената страна в ЕС, използваща неодобрени от ЕМА ваксини. Словакия също е поръчала дози от руската ваксина, но препаратът там все още не е одобрен и не се използва.
Публикацията е създадена с подкрепата на Европейския съюз. Отговорността за съдържанието е изцяло на Factcheck.bg, проект на Асоциацията на европейските журналисти – България срещу дезинформацията.

Ключови думи
За честна и независима журналистика
Ще се радваме, ако ни подкрепите, за да може и занапред да разчитате на независима, професионална и честна информационно - аналитична медия.
 1 коментар
1 коментар
Екипът на Mediapool Ви уведомява, че администраторите на форума ще премахват всички мнения, съдържащи нецензурни квалификации, обиди на расова, етническа или верска основа.
Редакцията не носи отговорност за мненията, качени в Mediapool.bg от потребителите.
Коментирането под статии изисква потребителят да спазва правилата за участие във форумите на Mediapool.bg
Прочетете нашите правила за участие във форумите.
За да коментирате, трябва да влезете в профила си. Ако нямате профил, можете да се регистрирате.





Защо не отговори на един много важен въпрос - Защо ваксинираните дават съгласие и защо се освобождават производителите на ваксини от всякаква наказателна отговорност?